Ngày 17/2, Sở Y tế TP HCM thông báo Cục Quản lý Dược (Bộ Y tế) đã phát đi công văn hỏa tốc về việc tạm dừng nhập khẩu, phân phối và sử dụng 7 loại thuốc do Công ty Mylan Laboratories Limited (Indore - Pithampur, Ấn Độ) sản xuất. Cảnh báo này dựa trên thông tin từ Cục Quản lý Thực phẩm và Dược phẩm Mỹ (USFDA), trong thư ngày 19/12/2024, cho biết công ty này vi phạm nghiêm trọng các quy định về thực hành tốt sản xuất (GMP).
Theo yêu cầu của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Bộ Y tế), các cơ sở kinh doanh và sử dụng thuốc phải ngưng nhập khẩu, phân phối và lưu hành các sản phẩm liên quan. Trong danh sách có ba loại thuốc do Công ty TNHH Viatris Việt Nam đăng ký: ADCClena 5, ADCClena 10 và ADCClena 25. Bốn loại còn lại do Mi Pharma Private Limited đăng ký gồm: Emtricitabine and Tenofovir Alafenamide Tablets 200 mg/25 mg, Hepbest, Acriptega và Avonza.
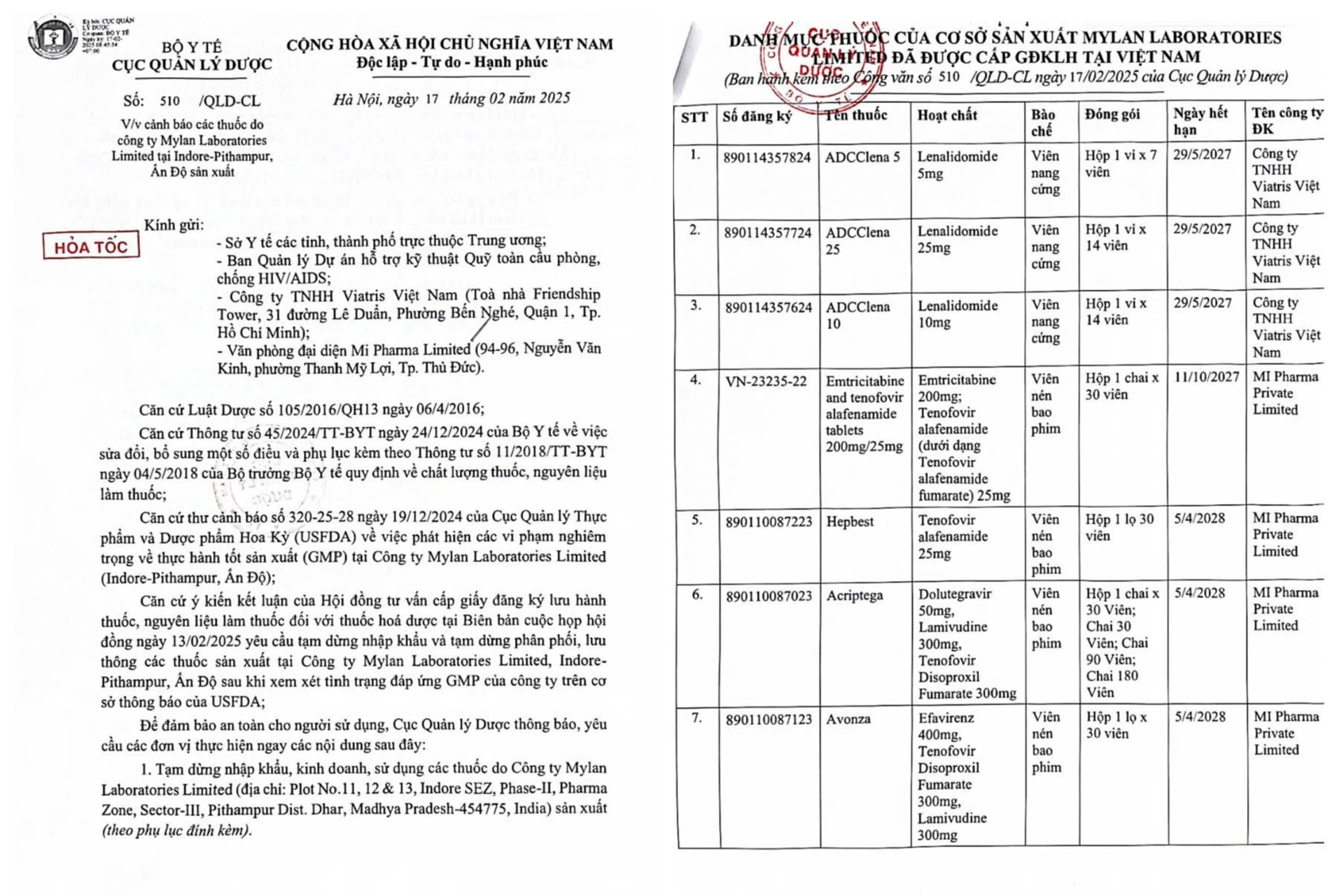
Cục Quản lý Dược yêu cầu các đơn vị liên quan niêm phong và bảo quản số thuốc hiện có tại cơ sở, đồng thời phối hợp với cơ sở đăng ký để báo cáo chi tiết về tình hình nhập khẩu, phân phối và sử dụng. Các thông tin cần cung cấp bao gồm tên cơ sở nhập khẩu, thời gian, số lượng nhập và phạm vi phân phối.
Sở Y tế các tỉnh, thành phố cũng được đề nghị thông báo đến các cơ sở khám chữa bệnh và đơn vị kinh doanh dược phẩm trên địa bàn về việc tạm ngừng lưu hành các thuốc này. Số thuốc hiện đang được bảo quản sẽ chờ kết luận chính thức về chất lượng và mức độ an toàn, trước khi có thông báo mới từ Cục Quản lý Dược.
-
 Hiểu lầm tài xế taxi bắt cóc, nữ sinh viên tử vong khi nhảy khỏi xe
20-02-2025 17:30 05
Hiểu lầm tài xế taxi bắt cóc, nữ sinh viên tử vong khi nhảy khỏi xe
20-02-2025 17:30 05 -
 Sự thật về chiếc váy hồng trăm người mặc lan truyền khắp mạng xã hội
20-02-2025 17:30 01
Sự thật về chiếc váy hồng trăm người mặc lan truyền khắp mạng xã hội
20-02-2025 17:30 01 -
 Vừa cầm bóng bay vừa thổi nến sinh nhật, cô gái bị bỏng khắp mặt
20-02-2025 15:43 42
Vừa cầm bóng bay vừa thổi nến sinh nhật, cô gái bị bỏng khắp mặt
20-02-2025 15:43 42
-
 Giáo viên tiểu học Hàn Quốc gây sốc vì cười lớn sau khi đâm chết học sinh 8 tuổi
19-02-2025 18:19 55
Giáo viên tiểu học Hàn Quốc gây sốc vì cười lớn sau khi đâm chết học sinh 8 tuổi
19-02-2025 18:19 55 -
 'Siêu nhân sườn xám' thành người hùng khi cứu bé gái đuối nước
19-02-2025 15:15 18
'Siêu nhân sườn xám' thành người hùng khi cứu bé gái đuối nước
19-02-2025 15:15 18 -
 Động viên bệnh nhân giảm béo, bác sĩ phẫu thuật giảm 25kg trong 42 ngày
19-02-2025 10:30 37
Động viên bệnh nhân giảm béo, bác sĩ phẫu thuật giảm 25kg trong 42 ngày
19-02-2025 10:30 37











